Wasser begegnet uns überall im Alltag. Es ist nicht nur das Getränk, das wir jeden Tag brauchen, sondern auch eine chemische Substanz mit erstaunlichen Eigenschaften. Aber wusstest du, dass die chemischen Eigenschaften von Wasser eine entscheidende Bedeutung für das Leben auf der Erde haben? Ohne Wasser könnte es keine Reaktionen in unseren Zellen geben, keine Pflanzen würden wachsen, und die Erde wäre ein ganz anderer Ort.
Wasser: die wichtigsten Fakten
- Molekülstruktur: Wasser besteht aus zwei Wasserstoff-Atomen (H) und einem Sauerstoff-Atom (O), chemische Formel H₂O.
- Dipol-Molekül: Wasser hat eine ungleiche Ladungsverteilung – der Sauerstoff ist leicht negativ, die Wasserstoffatome leicht positiv geladen.
- Wasserstoffbrückenbindungen: Diese Bindungen zwischen Wassermolekülen sind verantwortlich für viele Eigenschaften, wie die hohe Oberflächenspannung.
- Aggregatzustände: Wasser kommt in flüssiger, fester (Eis) und gasförmiger (Wasserdampf) Form vor.
- Dichteanomalie: Eis ist weniger dicht als flüssiges Wasser, weshalb es auf Wasser schwimmt.
- Neutraler pH-Wert: Reines Wasser hat einen pH-Wert von 7, es ist weder sauer noch basisch.
- Lösungsmittel: Wasser ist ein starkes Lösungsmittel und kann viele Stoffe wie Salz und Zucker auflösen.
Dieser Artikel erklärt, warum Wasser so besonders ist und welche chemischen und physikalischen Eigenschaften es einzigartig machen. Du erfährst, warum Wasser eine hohe Dichte hat, warum Eis schwimmt und was es mit den Wasserstoffbrückenbindungen auf sich hat. Wir werfen auch einen Blick darauf, wie Temperatur das Wasser beeinflusst und warum Wasser ein so gutes Lösungsmittel ist. Wasser ist also viel mehr als nur eine einfache Flüssigkeit – es ist ein echtes chemisches Wunder!

Das Wassermolekül H2O im Detail
Um die besonderen Eigenschaften von Wasser zu verstehen, schauen wir uns zuerst das Wassermolekül genauer an. Ein Molekül ist die kleinste Einheit einer chemischen Verbindung, die noch die typischen Eigenschaften des Stoffes besitzt. Es besteht aus Atomen, die durch chemische Bindungen miteinander verknüpft sind. Im Fall von Wasser besteht ein Molekül aus zwei Wasserstoffatomen (H) und einem Sauerstoffatom (O). Daher die chemische Formel: H₂O.
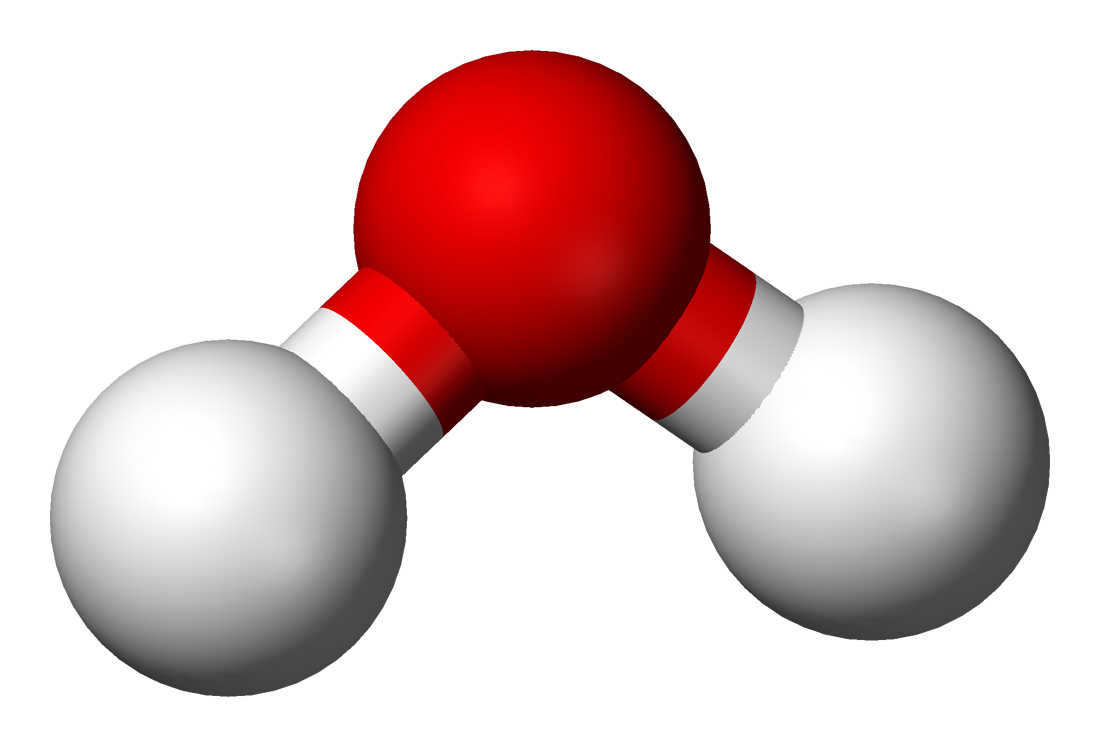
Was macht das Wassermolekül aber so besonders? Wasser ist ein sogenanntes Dipol-Molekül. Das bedeutet, dass die Ladung im Wassermolekül ungleichmäßig verteilt ist. Der Sauerstoff zieht die negativ geladenen Elektronen stärker zu sich, wodurch es eine leicht negative Ladung aufweist. Die Wasserstoffatome hingegen sind leicht positiv geladen.
Diese Ladungsverteilung führt dazu, dass Wassermoleküle sich wie kleine Magnete verhalten, die sich gegenseitig anziehen.
Diese Eigenschaft des Wassers, ein Dipol zu sein, ist verantwortlich für viele spezifische chemische Reaktionen und Eigenschaften, wie seine Fähigkeit, Verbindungen zu lösen, und die Bildung von Wasserstoff-Brückenbindungen zwischen den Wassermolekülen.
Aggregatzustände - Wasser als Flüssigkeit, Eis und Dampf
Wasser kann in drei verschiedenen Formen, den sogenannten Aggregatzuständen, vorkommen: fest, flüssig und gasförmig. Als Eis ist Wasser fest, bei Raumtemperatur ist es flüssig, und ab einer Temperatur von 100 °C verdampft es und wird gasförmig. Diese Phasenübergänge sind für viele natürliche Prozesse auf der Erde von großer Bedeutung.
Wenn Wasser gefriert, wandelt es sich bei 0 °C in Eis um. Die Wassermoleküle bewegen sich langsamer, bis sie eine feste Struktur bilden. Beim Erhitzen beginnt Wasser bei 100 °C zu kochen und wird zu Wasserdampf. In diesem Zustand sind die Wassermoleküle so schnell, dass sie sich voneinander lösen und in die Luft entweichen.
Die Dichteanomalie des Wassers bedeutet, dass Wasser bei 4°C seine höchste Dichte erreicht. Im Gegensatz zu den meisten Stoffen ist festes Wasser (Eis) weniger dicht als flüssiges Wasser. Daher schwimmt Eis auf Wasser. Diese Anomalie sorgt dafür, dass Seen und Flüsse im Winter von oben gefrieren, während das Wasser darunter flüssig bleibt, was das Überleben von Wasserlebewesen in kalten Regionen ermöglicht.
Eine spezifische Eigenschaft von Wasser ist seine Dichteanomalie. Normalerweise haben feste Stoffe eine höhere Dichte als flüssige. Bei Wasser ist das anders: Eis hat eine geringere Dichte als flüssiges Wasser, weshalb es auf Wasser schwimmt. Diese Anomalie spielt eine wichtige Rolle für das Leben auf der Erde, da Seen und Flüsse im Winter nicht komplett zufrieren, sondern das Eis an der Oberfläche schwimmt, wodurch die Temperatur unterhalb der Eisschicht stabil bleibt und viele Lebewesen überleben können.

Chemische und physikalische Eigenschaften von Wasser
Wasser hat besondere chemische und physikalische Eigenschaften, die eine wichtige Rolle in unserem Alltag und auf der Erde spielen. Farbe, Geruch und Geschmack von Wasser sind im reinen Zustand kaum wahrnehmbar. Es ist farblos, geruchlos und fast immer geschmacklos, da keine zusätzlichen Moleküle oder Ionen darin gelöst sind. Der Geschmack von Wasser kann jedoch variieren, wenn Mineralien und andere Moleküle, wie z.B. Sauerstoff, gelöst sind.
Ein weiteres wichtiges Merkmal von Wasser ist seine Dichte. Ein Liter Wasser wiegt ungefähr ein Kilogramm, was durch die spezielle Anordnung der Wassermoleküle verursacht wird. Diese Dichte ist entscheidend für viele natürliche Prozesse, wie die Zirkulation des Wassers auf der Erde.
Außerdem besitzt Wasser eine hohe Wärmekapazität. Das bedeutet, dass es viel Energie benötigt, um sich zu erwärmen. Diese Eigenschaft ist wichtig für das Klima, da Wasser große Mengen Wärme speichern kann, was die Temperatur auf der Erde stabil hält.
Ein weiteres physikalisches Phänomen ist die Oberflächenspannung des Wassers. Durch die starken Wasserstoffbrückenbindungen zwischen den Wassermolekülen entsteht eine Spannkraft an der Oberfläche. Diese hohe Oberflächenspannung ermöglicht es zum Beispiel, dass Insekten wie Wasserläufer über das Wasser laufen können.
Ein weiterer wichtiger chemischer Aspekt von Wasser ist sein pH-Wert. Der pH-Wert gibt an, wie sauer oder basisch eine Lösung ist. Reines Wasser hat einen pH-Wert von 7, was als neutral gilt. Das bedeutet, dass es weder sauer noch basisch ist. Dieser Wert entsteht, weil in Wasser immer eine kleine Menge an Ionen wie H₃O⁺ (Hydronium) und OH⁻ (Hydroxid) vorhanden ist. Der pH-Wert kann sich jedoch ändern, wenn andere Mineralien im Wasser gelöst sind. Zum Beispiel wird Wasser leicht sauer, wenn sich Kohlenstoffdioxid aus der Luft darin löst. Der pH-Wert von Wasser spielt eine wichtige Rolle in der Chemie, da er viele chemische Reaktionen beeinflusst, besonders in natürlichen Gewässern und in unserem Körper.
Chemie des Wassers: Wasser als Lösungsmittel
Wasser ist ein außergewöhnlich starkes Lösungsmittel und kann viele Stoffe auflösen. Diese Fähigkeit liegt an der besonderen Struktur der Wassermoleküle. Wasser ist ein sogenanntes polares Molekül, was bedeutet, dass es zwei entgegengesetzte elektrische Ladungen hat. Der Sauerstoff im Wassermolekül zieht die negativen Elektronen stärker an, während die Wasserstoff-Atome positiv geladen sind. Dadurch können die Teilchen andere polare Stoffe umhüllen und auflösen, indem sie die positiven und negativen Ionen dieser Verbindungen trennen.
Im Alltag sehen wir das, wenn wir Zucker in Tee auflösen oder Salz im Wasser vermischen. In beiden Fällen wirken die Wassermoleküle als unsichtbare Helfer, die die Stoffe in ihre Bestandteile zerlegen. Diese Eigenschaft hat auch eine wichtige Bedeutung in der Natur: Im Trinkwasser sind viele wichtige Nährstoffe gelöst, die Pflanzen aufnehmen können. Auch in unserem Körper spielt Wasser eine zentrale Rolle, da es Nährstoffe transportiert und für viele chemische Reaktionen notwendig ist.
Wasserstoffbrückenbindungen - Die Superkraft des Wassers
Eine der größten Stärken des Wassers liegt in den Wasserstoff-Brückenbindungen. Aber was sind Wasserstoffbrückenbindungen eigentlich? Diese besonderen Bindungen entstehen, wenn die leicht positiv geladenen Wasserstoff-Atome eines Wassermoleküls von den negativ geladenen Sauerstoffatomen eines benachbarten Wassermoleküls angezogen werden. So verbinden sich die Teilchen miteinander, fast wie durch unsichtbare Magneten. Diese Bindungen sind zwar schwächer als echte chemische Bindungen, aber sie sind stark genug, um viele der besonderen Eigenschaften von Wasser zu erklären.
Ein Beispiel für die Bedeutung der Wasserstoff-Brückenbindungen ist die Oberflächenspannung. Diese Bindungen sorgen dafür, dass die Wassermoleküle an der Oberfläche besonders eng zusammenhalten. Deshalb können Insekten wie Wasserläufer über das Wasser laufen, ohne unterzugehen. Ein weiteres Beispiel ist der hohe Siedepunkt von Wasser. Es braucht viel Energie, um die Wasserstoffbrückenbindungen zu lösen und Wasser in Wasserdampf zu verwandeln. Ohne diese Bindungen würde Wasser schon bei viel niedrigeren Temperaturen verdampfen.
Diese unsichtbare Kraft ist entscheidend für viele der chemischen und physikalischen Eigenschaften des Wassers, die uns im Alltag begegnen – sei es in der Natur oder bei der Erwärmung unseres Trinkwassers.
Wasser und Elektrizität
Ob Wasser Strom leitet, hängt davon ab, welche anderen Verbindungen in ihm gelöst sind. Reines Wasser, also Wasser ohne Verunreinigungen, leitet Strom nur sehr schlecht. Das liegt daran, dass in reinem Wasser kaum freie Ionen vorhanden sind, die als elektrische Leiter fungieren könnten. Ohne Ionen können keine elektrischen Ladungen durch das Wasser fließen.
Im Gegensatz dazu leitet Leitungswasser deutlich besser Strom. Das liegt daran, dass im Trinkwasser oft Salze und Mineralien wie Natrium, Calcium und Magnesium gelöst sind.

Diese gelösten Mineralien sorgen für die Freisetzung von Ionen, die es dem Strom ermöglichen, durch das Wasser zu fließen. Die chemischen und physikalischen Eigenschaften des Wassers ändern sich also stark, je nachdem, welche Stoffe gelöst sind.
Ein noch deutlicheres Beispiel ist Meerwasser. Meerwasser enthält viel mehr gelöste Salze als Leitungswasser, vor allem Natriumchlorid (Kochsalz). Dadurch ist die Leitfähigkeit von Meerwasser besonders hoch. Die vielen Ionen im Meerwasser ermöglichen einen stärkeren Stromfluss im Vergleich zu normalem Trinkwasser.
Diese hohe Salzkonzentration beeinflusst auch andere physikalische Eigenschaften, wie die Dichte des Wassers – Meerwasser ist dichter als Süßwasser, was sich auf die Dichteanomalie des Wassers auswirkt.
In der Chemie ist die Fähigkeit von Wasser, elektrische Energie zu leiten, ein wichtiger Faktor bei vielen Reaktionen. Diese Fähigkeit kann durch die Zugabe bestimmter Stoffe verstärkt werden, was die Rolle von Wassers als Lösungsmittel und Leiter in chemischen Prozessen unterstreicht. Ohne Wasser auf der Erde wäre das Leben nicht möglich.
Mit KI zusammenfassen:














