Das Periodensystem der Elemente, PSE, ist eine der wichtigsten Errungenschaften der Chemie. Entwickelt wurde es 1869 durch den russischen Chemiker Dmitri Mendelejew, der erkannte, dass die Elemente bestimmten Gesetzmäßigkeiten folgen.
Bereits im 18. Jahrhundert wurden einige chemische Elemente entdeckt. Die Geschichte der Chemie geht also weit zurück in die Vergangenheit. Der Großteil wurde aber erst im 19. Jahrhundert entdeckt und wissenschaftlich beschrieben. Heute umfasst das Periodensystem 118 Elemente, von denen viele essenziell für unser Leben und die moderne Technik sind.
In diesem Artikel werfen wir einen Blick auf den Aufbau, die Geschichte und die Bedeutung des Periodensystems in Wissenschaft und Alltag.

Aufbau Periodensystem
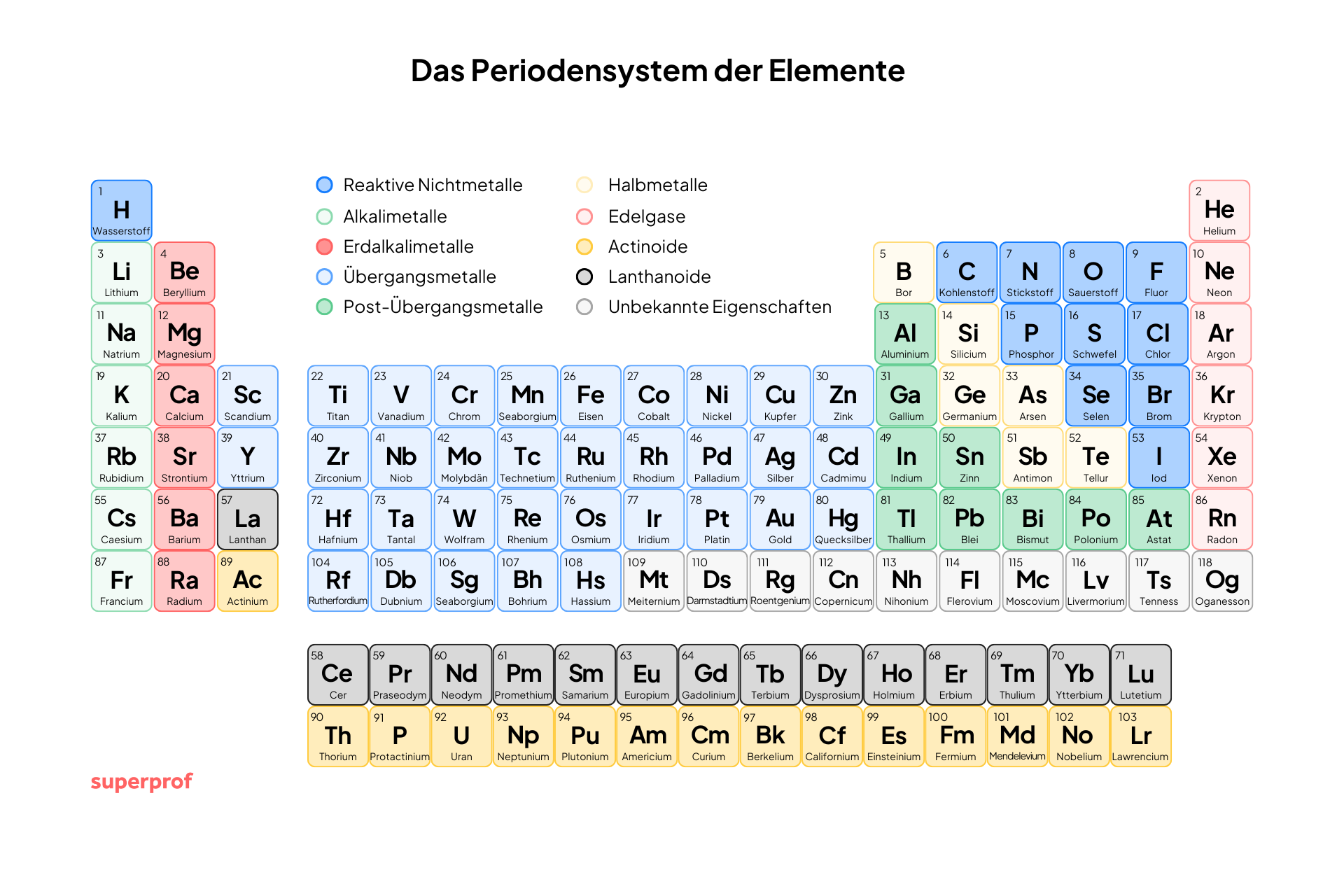
Das geordnete Darstellung aller bekannten chemischen Elemente und bildet die Grundlage der modernen Chemie. Es zeigt nicht nur die Ordnungszahlen und Atommassen, sondern auch die chemischen und physikalischen Eigenschaften der Elemente in einem logischen System.
Ein chemisches Element ist ein Reinstoff, der mit chemischen Methoden nicht mehr in andere Stoffe zerlegt werden kann.
Jedes Element nimmt einen bestimmten Platz ein, der seine Elektronenkonfiguration und sein Verhalten in chemischen Reaktionen widerspiegelt. Mit einem Blick auf das Periodensystem lassen sich also wesentliche Eigenschaften der Elemente ablesen und Ergebnisse von Reaktionen annähernd bestimmen.
Doch wie genau ist das Periodensystem als Teilgebiet der anorganischen Chemie aufgebaut? Kommen wir zu Periodensystem Erklärung.
Elementsymbole
Jedes Element wird durch einen bestimmten Buchstaben abgekürzt. In der Regel gehen die Abkürzungen auf den lateinischen Namen zurück.
- Das O für Sauerstoff leitet sich von der lateinischen Bezeichnung Oxygenium ab
- Das H für Wasserstoff geht auf den Namen Hydrogenium zurück.
Die durchlaufende Nummerierung im Periodensystem wird als Ordnungszahl bezeichnet. Wie viele Elemente gibt es im Periodensystem?
Derzeit gibt es 118 Elemente, die im Periodensystem verzeichnet sind. Die Ordnungszahl ist nicht nur eine Nummer für eine übersichtliche Anordnung, sondern gibt gleichzeitig an, wieviele Protonen, also positiv geladene Teilchen sich im Atomkern befinden.
In einem neutralen Atom entspricht die Ordnungszahl auch der Anzahl der Elektronen.
Ordnungszahl = Anzahl der Protonen im Atomkern
Die Elemente sind im Periodensystem nach steigender Ordnungszahl geordnet.
Die Gruppen im Periodensystem
Das Periodensystem ist in Zeilen (Perioden) und Spalten (Gruppen) unterteilt, die die genauen Eigenschaften der Elemente widerspiegeln. Elemente, die im Periodensystem untereinander stehen, bilden jeweils eine Gruppe. Das Periodensystem gliedert sich in acht Haupt- und zehn Nebengruppen.
Alle Hauptgruppenelemente einer Gruppe besitzen ähnliche chemische Eigenschaften, weil sie auf der äußeren Schale über die gleiche Anzahl von Elektronen verfügen, die sogenannten Valenzelektronen.
Beim Aufbau Periodensystem lassen sich acht Hauptgruppen bestimmen:
Gruppe
Alkalimetalle (1. Gruppe)
Erdalkalimetalle
Borgruppe
Kohlenstoffgruppe
Stickstoffgruppe
Chalkogene (6. Gruppe)
Halogene (7. Gruppe)
Edelgase (8. Gruppe)
Eigenschaft
besonders reaktiv
am Aufbau der Erdkruste beteiligt
Erdmetalle
unterschiedliche chemische Eigenschaften
natürlich vorkommenden Elemente
oft in Form von Salzen und Mineralien
Salzbildner
keine Neigung zu chemische Reaktionen
Daneben gibt es einige Nebengruppen, die sich jeweis vom ersten Element der jeweiligen Gruppe ableiten. Alle Nebengruppenelemente sind Metalle und bilden farbige, stabile Komplexverbindungen.
Die Elemente jeder Gruppe besitzen die gleiche Anzahl an Valenzelektronen, was zu ähnlichen chemischen Eigenschaften führt.
In der Gruppenanorndung spielt die sogenannte Oktettregel eine Rolle, die besagt, dass jedes Element bestrebt ist, acht Elektronen auf seiner äußerten Schale zu haben, um die Edelgaskonfiguration zu erreichen. Eine Ausnahme ist das Wasserstoffatom, das anstrebt nur ein weiteres Elektron aufzunehmen.
Erfahre mehr zum Teilgebiet der oragnischen Chemie!
Die Perioden im Periodensystem
Die Zeilen im Periodensystem werden als Perioden bezeichnet. Die sieben Perioden des PSE geben die Anzahl der Elektronenschalen eines Elements an. Innerhalb einer Periode nimmt die Ordnungszahl von links nach rechts zu, wodurch sich Eigenschaften wie Elektronegativität und Atomradius systematisch verändern.
Bestreben eines Atoms, innerhalb eines Moleküls Bindungselektronen an sich zu ziehen. Die Elektronegativität nimmt im Periodensystem von unten nach oben und von links nach rechts zu.
Die Schalen im Periodensystem symbolisieren die Kreisbahnen, auf denen sich die Elektronen bewegen. Sie werden auch als “Energieniveau” bezeichnet. Früher wurden die Eigenschaften mithilfe des Schalenmodells bezeichnet, das heutzutage durch das Orbitalmodell ersetzt wurde.

Die Werte der Elektronegativität sind im Periodensystem für jedes Element eingetragen und die Differenz zwischen zwei Elementen muss immer positiv sein:
- Bei Werten unterhalb von 0,1 ist die Bindung unpolar und es liegt eine kovalente Atombindung vor.
- Ergibt die Differenz der Elektronegativität einen Wert von 0,1 bis 0,4, handelt es sich um eine schwache polare Atombindung.
- Eine starke polare Atombindung liegt bei Werten von 0,4 bis 1,7 vor.
- Ist die Differenz der Elektronegativität der beteiligten Elemente größer als 1,7, spricht man von einer ionischen Verbindung.
Die Eigenschaften der Elemente spielen in Chemie und Physik eine Rolle.
Die Anzahl der Protonen und Elektronen steigt von links nach rechts.
Die Elektronegativität ist Anhaltspunkt für die Polarität, das heißt für die Ladungsschwerpunkte und den Ionenbindungcharakter einer Bindung.
Regelmäßigkeiten im Periodensystem der Elemente
Die systematische Anordnung der Elemente zeigt klare Regelmäßigkeiten, die auf der Elektronenkonfiguration der Atome beruhen und die chemischen und physikalischen Eigenschaften der Elemente beeinflussen.
Schauen wir uns einige Regelmäßigkeiten an:
Atomradius
- Innerhalb einer Periode: Nimmt von links nach rechts ab, da die steigende Kernladung die Elektronen stärker anzieht.
- Innerhalb einer Gruppe: Nimmt von oben nach unten zu, da mit jeder neuen Periode eine zusätzliche Elektronenschale hinzukommt.
Ionisierungsenergie (Energie zum Entfernen eines Elektrons)
- Innerhalb einer Periode: Nimmt von links nach rechts zu, da Elektronen stärker gebunden sind.
- Innerhalb einer Gruppe: Nimmt von oben nach unten ab, da die äußeren Elektronen weiter vom Kern entfernt sind und leichter entfernt werden können.
Elektronegativität (Tendenz, Elektronen anzuziehen)
- Innerhalb einer Periode: Steigt von links nach rechts, da Atome kleiner werden und stärker Elektronen anziehen.
- Innerhalb einer Gruppe: Sinkt von oben nach unten, da die Anziehungskraft auf die Valenzelektronen schwächer wird.
Metallcharakter
- Innerhalb einer Periode: Nimmt von links nach rechts ab, da Elemente auf der linken Seite (Metalle) Elektronen leichter abgeben.
- Innerhalb einer Gruppe: Nimmt von oben nach unten zu, da die äußeren Elektronen leichter abgegeben werden können.
Das Periodensystem folgt klaren Regelmäßigkeiten, die es ermöglichen, Eigenschaften von Elementen vorherzusagen.
Bedeutung und Anwendungen des Periodensystems
Das Periodensystem der Elemente ist eines der wichtigsten Werkzeuge der Chemie. Es ordnet alle bekannten chemischen Elemente systematisch und ermöglicht Vorhersagen über deren Eigenschaften und Reaktionen. Es hilft Wissenschaftlern, Elemente zu klassifizieren und Zusammenhänge zwischen ihnen zu verstehen.

Seine Bedeutung reicht jedoch weit über die Chemie hinaus und erstreckt sich auf zahlreiche Wissenschafts- und Industriebereiche. Schauen wir uns einige Beispiel an:
- Chemische Industrie: die Herstellung von Farben, Kunststoffen, Medikamenten und Düngemitteln sowie die Entwicklung von Legierungen und Halbleitermaterialien basiert auf dem Wissen über chemische Elemente.
- Medizin und Pharmazie: Viele Medikamente enthalten essentielle Elemente wie Eisen (Fe) oder Magnesium (Mg). Auch die Nuklearmedizin nutzt radioaktive Isotope für Krebsbehandlungen und Diagnostik.
- Energiewirtschaft: Kernkraftwerke nutzen radioaktive Elemente wie Uran (U) zur Energiegewinnung. Erneuerbare Technologien setzen auf Materialien wie Silicium (Si) für Solarzellen.
- Astronomie: Die Analyse von Elementhäufigkeiten gibt Aufschluss über die Entstehung von Planeten und Sternen.
- Geologie: Geologen nutzen das PSE zur Bestimmung von Mineralien und Gesteinen.
Geschichte des Periodensystems
Die Entwicklung des Periodensystems begann mit frühen Versuchen, die bekannten Elemente systematisch zu ordnen und führte schließlich zu der heute gebräuchlichen Tabelle. Ein Blick in die Geschichte!
Erste Klassifikationen der Elemente
Die Idee, eine Anordnung der chemischen Elemente zu erstellen, basiert auf historischen Grundlagen. Bereits in der Antike wurden Stoffe in Gruppen eingeteilt. Die Griechen unterschieden beispielsweise die vier Elemente:
Erde
Wasser
Luft
Feuer
Erst mit der Entwicklung der modernen Chemie im 18. und 19. Jahrhundert begannen Wissenschaftler, Elemente systematisch zu klassifizieren.
Im 19. Jahrhundert wurden immer mehr chemische Elemente bekannt. Das Bemühen, diese Elemente überschaubar anzuordnen, wuchs stetig. So ging man dazu über, die Elemente nach einer Eigenschaft zu sortieren.
Diese Eigenschaft war die Fähigkeit des Elements, elektrischen Strom zu leiten. Hierbei wurden die Leiter als Metalle bezeichnet und die Elemente, welche den elektrischen Strom nicht leiteten, als Nichtmetalle. Diese einfache Einteilung war eine erste Grundlage.

Als nächsten Schritt unterteilte man die Atome nach Gewicht. Die Atommasse wurde zur zweiten wichtigen Größe, um die Elemente zu ordnen, jedoch gelang das wegen der limitierten Messmethodik nur begrenzt.
In der Folge wurden die Elemente nach ihrer Reaktionsfähigkeit mit Wasser oder Sauerstoff untersucht. So wurde zwischen dem sauren, laugenhaften und alkalischen Charakter unterschieden.
Die Einteilung der Elemente in Familien trug zur Entwicklung des Periodensystems bei. Die Forscher stellten fest, dass verschiedene Stoffe ähnliche Eigenschaften aufwiesen und kategorisierten diese. So entstanden die Familien der Elemente.
Erste Tabellen und Ordnungssysteme
Anfang des 19. Jahrhunderts stellte Johann Wolfgang Döbereiner erstmals einen Zusammenhang zwischen der Atommasse und den chemischen Eigenschaften einzelner Elemente fest. Er erkannte die sogenannte Triadenregel:
- Gruppen von drei Elementen (z. B. Lithium, Natrium, Kalium) zeigten ähnliche Eigenschaften.
- Das mittlere Element wies einen Mittelwert der Massen und Eigenschaften der anderen beiden auf.
John Newlands erkannte 1864 die Oktavenregel: Er stellte fest, dass sich nach jeweils acht Elementen ähnliche chemische Eigenschaften wiederholen – ähnlich wie in der Musik. So wurde eine nach Atommassen geordnete Tabelle der Elemente in Achtergruppen geschaffen.
Dmitri Mendelejew und die moderne Periodentafel
Der russische Chemiker Dmitri Mendelejew gilt als der eigentliche Begründer des Periodensystems. Er ordnete die damals bekannten 63 Elemente nach steigender Atommasse und erkannte eine periodische Wiederholung ihrer Eigenschaften.
Er ließ Lücken für unbekannte Elemente und konnte deren Eigenschaften erstaunlich genau vorhersagen (z. B. Gallium, Germanium und Scandium). Mendelejews System war bahnbrechend, da es nicht nur eine Ordnung, sondern auch eine Vorhersagekraft besaß.
Die Entdeckung der Ordnungszahl
Während Mendelejew sein System noch nach Atommasse ordnete, erkannte der britische Physiker Henry Moseley, dass die Ordnungszahl (Protonenzahl) der entscheidende Faktor für die Elementanordnung ist. Dies führte zur modernen Form des Periodensystems.
Mit KI zusammenfassen: